肿瘤微环境中细胞、细胞外基质和空间结构的异质性是导致药物治疗获益率低的主要原因。目前肿瘤耐药相关研究的瓶颈在于缺乏仿生肿瘤微环境的体外模型,尽管二维细胞培养和动物模型在癌症研究中应用广泛,但它们无法再现真实肿瘤的异质性特征。生物三维打印肿瘤模型通过整合肿瘤细胞、间质细胞和仿生肿瘤细胞外基质,能够实现肿瘤微环境特征的体外重构,但仍无法模拟肿瘤微环境的复杂异质性,例如生物学特征和生物物理特征的空间异质性。因此,利用工程学及肿瘤生物学原理体外仿生模拟肿瘤异质性微环境,对于深入探究复杂的细胞相互作用和阐明微环境介导的耐药机制至关重要。
近期,清华大学深圳国际研究生院孙伟、弥胜利教授团队与中山大学附属第一医院刘纯教授团队合作,采用挤出式多喷头生物三维打印技术,将乳腺癌细胞、内皮细胞、人乳腺癌相关成纤维细胞和仿生细胞外基质通过调控空间排布方式,构建了具有空间异质性的乳腺癌模型。该模型高度模拟了乳腺癌微环境的关键生理特征,包括三维血管网络和机械刚度的生物物理异质性,验证了与肿瘤血管生成和细胞外基质重塑相关的细胞相互作用,论证了微环境的空间异质性对乳腺癌细胞耐药性的影响。利用这一平台将促进肿瘤微环境中细胞间和肿瘤-基质相互作用的机制研究,以及靶向肿瘤微环境的抗癌新疗法的开发。
在该项工作中,团队构建的打印模型重现了人乳腺癌样本中大小不同的癌细胞密集区域和富含微血管的间质区域的空间分布特点。进一步,团队发现经过体外培养后的打印模型中血管生成和细胞外基质硬化发生在间质区域而非癌细胞密集区域,成功模拟了患者样本中的病理特征。生物打印模型实现了生物和生物物理因素的整合,为研究肿瘤微环境内细胞组分和机械力学不同分区中潜在的分子特征和配受体互作提供了高效研究平台。转录组分析揭示了在间质区域而非癌细胞密集区域,血管生成和细胞外基质重塑的相关基因表达上调,并确定了调控这些过程的潜在配受体互作。最后,团队发现加入药物后的打印模型中间质区域的癌细胞表现出更强的化疗药物抵抗性,从而揭示了异质性微环境介导的肿瘤耐药。
综上所述,该研究构建了一种基于生物3D打印的空间异质肿瘤模型,为研究肿瘤微环境调控肿瘤发生发展机理提供了新的系统性工具,还可以为肿瘤耐药性研究提供可靠的治疗靶点及药物筛选平台。
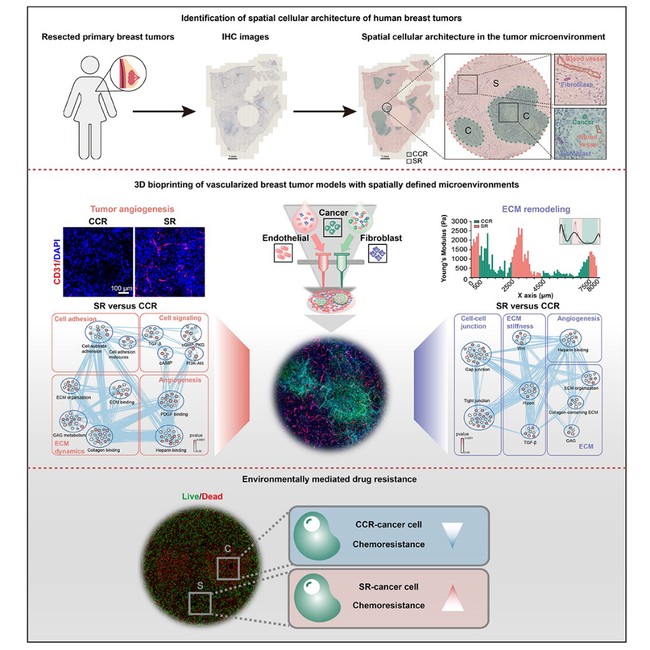
图1 生物打印的、空间定义的具有瘤内异质性和耐药性的乳腺肿瘤微环境模型
相关研究成果以“生物打印的、空间定义的具有瘤内异质性和耐药性的乳腺肿瘤微环境模型”(Bioprinted, spatially defined breast tumor microenvironment models of intratumoral heterogeneity and drug resistance)为题发表在《生物技术趋势》(Trends in Biotechnology)上,并被选为期刊封面。本文通讯作者为清华-伯克利深圳学院孙伟教授、中山大学附属第一医院刘纯教授、清华大学深圳国际研究生院弥胜利教授和密歇根医学院加里·卢克(Gary D. Luker)教授。第一作者为清华-伯克利深圳学院2018级博士生袁天莹、中山大学精准医学研究院2022级硕士生傅锡洪。
原文链接:
https://doi.org/10.1016/j.tibtech.2024.06.007
图/文:袁天莹
编辑:戴雨静
审核:陈超群








