冷冻保存技术是细胞治疗、再生医学、器官移植及生物资源保存的基础支撑技术,其中冰晶的形成、长大与重结晶,是所有冻存系统最主要且难以被完全避免的损伤来源。然而,当保存对象从单细胞扩展到复杂组织甚至大尺寸器官时,冰晶的形成、扩散以及复温过程中出现的重结晶,会迅速放大对结构和功能的破坏。特别是在器官级样本中,由于尺寸大、结构复杂、区域成分差异显著,复温过程中大样本内部往往形成显著的温度梯度与热应力,诱发严重的重结晶和机械应力损伤。因此,实现真正的跨尺度冻存,必须同时破解低温下的抑冰能力、复温阶段的高效均匀升温能力两个核心问题——这一点决定了样本从单细胞到器官能否被完整保存。
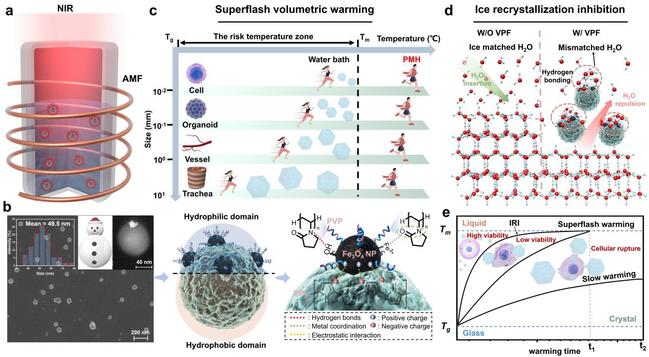
图1. 面向跨尺度冻存的高效抑冰和升温设计
针对这一长期瓶颈,清华大学深圳国际研究生院耿洪亚团队在前期研究抗冻多肽和抑冰-光热纳米冻存剂的基础上,设计了一种具有雪人状结构的Janus纳米杂化材料(VPF)。从“抑冰–升温”两条主线同步展开,通过结构设计、界面调控与能量耦合策略,实现了在微观与宏观尺度上均极具突破性的抑冰与超快均匀复温能力(图1)。
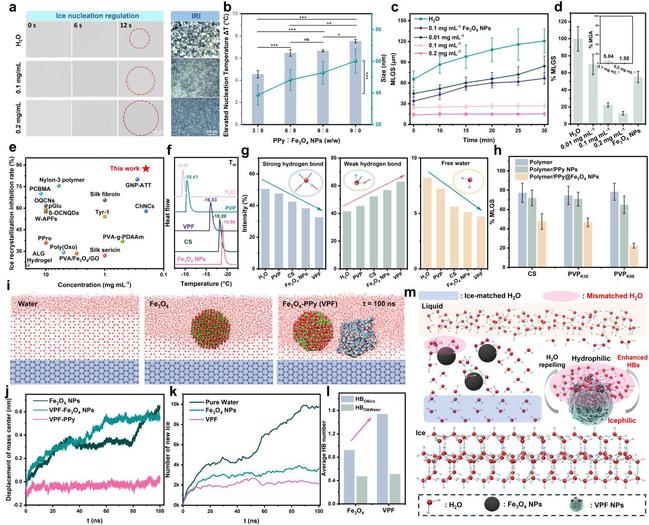
图2. Janus纳米杂化物实现高效抑冰及其界面调控机制解析
研究中构筑的Janus材料由磁性Fe3O4 NPs与光热PPy不对称组合而成,形成一个类似雪人的头部–躯体结构。这一结构在冰–水界面表现出极强的“水化–去匹配”双调控效应:Fe3O4 NPs通过强水合作用破坏局部氢键网络,削弱自由水分子与冰界面的匹配;PPy“躯体”与冰晶表面贴合形成微曲界面,通过Gibbs-Thomson效应抑制重结晶,并驱动水分子由冰界面转移至亲水头部。分子动力学模拟进一步揭示了这种Janus构型在冰-水界面的协同抑冰机制,使冰晶平均面积减少高达98.4%(图2)。

图3. Janus纳米杂化物在跨尺度体系中缩窄热危险区间的高效升温性能
在升温方面,该材料基于光热–磁热协同原理,能够在交变磁场(AMF)和近红外光(NIR)作用下产生动态旋转,使热量得以在各方向迅速、均匀扩散。与传统外水浴加热方式不同,VPF在组织内部实现“热源自内而外”的体相加热模式,从根本消除温度梯度与热应力问题,使大尺度组织得以安全通过最危险的结冰温度区间(图3)。该方法实现了超过920 ℃/min的超快升温速率,并可穿透数厘米厚组织,为器官级冻存提供了此前难以实现的复温条件。

图4. 猪气管的结构化冻存与复温效果展示
依托这一抑冰–升温双机制,人脐静脉内皮细胞、MSC、神经细胞等多种细胞类型均保持高活性与功能;益生菌在无DMSO情况下仍保有近86%活性;神经细胞球在低浓度冷冻保护剂(CPA)条件下完整保留了3D结构、线粒体功能与后续神经分化潜能;在复杂度更高的50 mL级猪气管样本中,组织纤毛、胶原分布及力学特性均与新鲜组织高度一致,显示出对器官尺度的良好适配性(图4)。更为关键的是,VPF具备优异的磁响应特性,可在升温后实现超过98%的快速分离,极大降低了操作难度,便于未来GMP转化。
这一工作提出了从单细胞到类器官,再到复杂管腔组织乃至器官级体系的通用冻存策略,为构建高质量类器官库、推动精准医疗、促进细胞与组织制剂产业化提供了新的技术基础。
相关成果以“Janus纳米杂化材料实现跨尺度冻存的超快复温与高亲和抑冰效应”(Janus Nanohybrids Enable Superflash Warming and High-Affinity Ice Confinement for Cross-Scale Cryopreservation)为题,以研究论文形式发表在《先进材料》(Advanced Materials)期刊上。
耿洪亚为论文通讯作者,清华大学深圳国际研究生院2023级硕士生柯涛和2023级博士生范欣为共同第一作者。该研究得到了国家自然科学基金委、教育部、北京市科技计划、广东省科技厅及深圳市科创局等单位和项目基金的支持。
论文链接:
https://advanced.onlinelibrary.wiley.com/doi/full/10.1002/adma.202515996
文:耿洪亚、陈超群
编辑:叶思佳
审核:林洲璐








